盐类水解规律总结
王婕燕
“盐类水解”是高二同学常常学不明白的重点和难点,因此我给同学们总结了本节的知识点,希望能帮助到大家。
盐溶液中的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。其实质是水解反应破坏了水的电离平衡,改变了溶液中H+和OH-的相对浓度,使溶液呈酸性或碱性。
盐类水解反应可以看作是酸碱中和反应的逆反应,具体特点如下:
①反应可逆 盐类水解一般是可逆的,故存在水解平衡。
②程度微弱 盐类水解一般比较微弱,进行程度小。
③吸收热量 由于中和反应为放热,故盐类水解吸收热量。
盐类水解规律: 谁弱谁水解, 谁强显谁性。
无弱不水解, 都弱都水解。
越弱越水解, 越热越水解。
根据以上规律,可以把盐类水解分成以下几种类型:
(1)强碱弱酸盐水解(如:CH3COONa、K2CO3、NaHCO3等),其实质是弱酸根离子水解,消耗了水中的H+,使C(H+)<C(OH-),溶液显碱性,pH>7,此类水解还应注意以下三个问题:
①、弱酸的酸式酸根离子既水解又电离,溶液的酸碱性取决了水解程度和电离程度的相对大小。如HCO3-、HPO42-、以水解为主;H2PO4-、HSO3-则以电离为主。
②由于各种弱酸的酸性强弱不同,因此不同的强碱弱酸盐的水解程度也不同,弱酸的酸性越弱,该弱酸根离子就越易结合H+,就越易水解,溶液的碱性就越强。例如,物质的量浓度相同的CH3COONa和NaH2PO4溶液,其pH值CH3COONa大于NaH2PO4。
③多元弱酸根离子的水解是分步的。如Na2CO3溶液的水解分两步:第一步,CO32-+H2O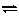 HCO3-+ OH-,第二步,HCO3-+H2O
HCO3-+ OH-,第二步,HCO3-+H2O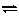 H2CO3+ OH-,其中第一步水解是主要的,溶液的酸碱性主要取决于第一步的水解程度。
H2CO3+ OH-,其中第一步水解是主要的,溶液的酸碱性主要取决于第一步的水解程度。
(2)强酸弱碱盐水解(如NH4Cl、CuSO4、FeCl3等),其实质是弱碱阳离子水解,消耗了水中的OH-,使溶液中H+浓度相对较大,C(H+)>C(OH-),溶液显酸性,pH<7。多元弱碱阳离子的水解简化成一步完成,如在AlCl3溶液中,Al3++3H2O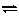 Al(OH)3+3H+
Al(OH)3+3H+
(3)弱酸弱碱盐(如: CH3COONH4、Al2S3等)其盐溶液中阳离子结合水中的OH-,阴离子结合水中的H+,相互促进水解,水解程度较大,此时溶液的酸碱性由生成的弱碱和弱酸的相对强弱决定。
a、酸强于碱显酸性 如(NH4)2SO3等
b、碱强于酸显碱性 如NH4CN等
c、酸碱相当显中性 如CH3COONH4等
在弱酸弱碱盐中有些盐如Al2S3等,由于阴、阳离子都易水解,且水解产物中有气体或难溶物质,这些盐的水解往往能进行彻底,水解方程用“=”表示,并在生成物中标出 “↑”或“↓”。如:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
符合此类情况的还有:Al3+与HCO3-、CO32-、ClO-、HS-等
Fe3+与HCO3-、CO32-、AlO2-、SiO32-等.

